化学问题的研究对象总是从两个方面研究的,一为内因,一为外因,内因为结构,外因为环境变量
稀溶液的依数性
溶液(solution):两种或两种以上物质彼此以
分子或离子状态均匀混合所形成的分散体系
溶液的依数性只与溶剂的本性和溶液的浓度有关
1.溶液蒸气压的下降
蒸气压:所有物质都有蒸气压,蒸气压指物质的气相与其非气相达到平衡状态时的压强
蒸气压的影响因素:内因:物质种类(结构决定性质)
外因:温度
溶液蒸气压下降的原因:溶液的单位体积和单位表面上由于溶质分子的加入,溶剂分子数随之减小,造成单位时间逸出页面的溶剂分子数减少,蒸气压减小
结论:同一温度下1.溶液的蒸汽压比纯溶剂蒸汽压低;2.溶液浓度越大,蒸汽压越低
拉乌尔定律:
Δp=Kb
K=MA*P*
一定温度下,溶液蒸气压下降与溶质质量摩尔浓度成正比,与溶质本性无关
2.溶液的沸点升高
溶液的沸点(Tb)
沸点:液体的蒸气压等于外压的温度
溶液沸点升高
原因:溶液的蒸气压比溶剂低
结论:难挥发性非电解质稀溶液的沸点升高只与溶质的质量摩尔浓度有关,与溶质的本性无关;纯溶剂沸点不变,溶液沸点变化‘
3.溶液凝固点降低
纯溶剂凝固点(Tf)
凝固点:液相蒸气压=固相蒸气压
溶液凝固点
溶液凝固是溶剂凝固
难挥发性非电解质稀溶液的凝固点总是比纯溶剂凝固点低
结论:难挥发性非电解质稀溶液凝固点降低只与溶质的摩尔质量浓度有关
4.蒸气压的应用
测算分子摩尔质量
ΔT=Kf·bB=Kf·nb/ma=Kf·mb/(Mb·ma)
整理得:Mb=Kb·Mb/(ΔT·ma)
—————————————————————————————————————————————
1.渗透压
溶液浓度和渗透压没有确定的关联
渗透现象
方向由溶剂分子数目多向少的渗透
条件:
半透膜
膜两侧单位体积内溶剂分子数不等
渗透平衡
膜两侧通过半透膜数目相等时动态平衡
渗透压
维持渗透平衡的超额压力,用Π表示
2.渗透压的依数性
Π=cRT≈bRT(kPa)
渗透压与溶质本性无关
3.渗透压的应用
Π=cRT=(n/V)RT=(mB/MB·V)RT MB=mBRT/ΠV34
4.电解质稀溶液的依数性
Δp=iKbB
ΔTb=iKfbB
ΔTf=iKb·bB
Π=icRT
i为修正因子
5.渗透压在医学上的意义
渗透浓度
单位溶液中产生渗透作用的溶质粒子数量,电解质要在浓度基础上修正
等渗溶液:Cos=280-320mmol/L
高渗溶液:Cos>320mmol/L
低渗溶液:Cos<280mmol/L
电解质溶液
1.强电解质溶液理论
2.酸碱质子理论
酸:凡能够给出质子的物质
碱:凡能够接受质子的物质
酸碱半反应
酸(HB)⇌质子(H+)+共轭碱(B-)
质子(H+)+碱(B-)⇌共轭酸(HB)
共轭酸碱对中,共轭酸越强,共轭碱越弱,反之亦然
酸碱反应的实质:质子传递反应
酸碱的强度
与物质本身性质有关,与溶剂也有关
如:醋酸在液氨中是强酸,在水中是弱酸,硝酸在水中是强酸,在冰醋酸中是弱酸
溶剂的拉平效应和区分效应
再强的酸在水中都是以水合氢离子和共轭碱存在,酸性一样,扔到冰醋酸中就能区分开
水溶液中的质子转移平衡及有关计算
水质子自递平衡常数(Kw)
H2O+H2O⇌H3O++OH- Kw=10^-14
质子转移平衡
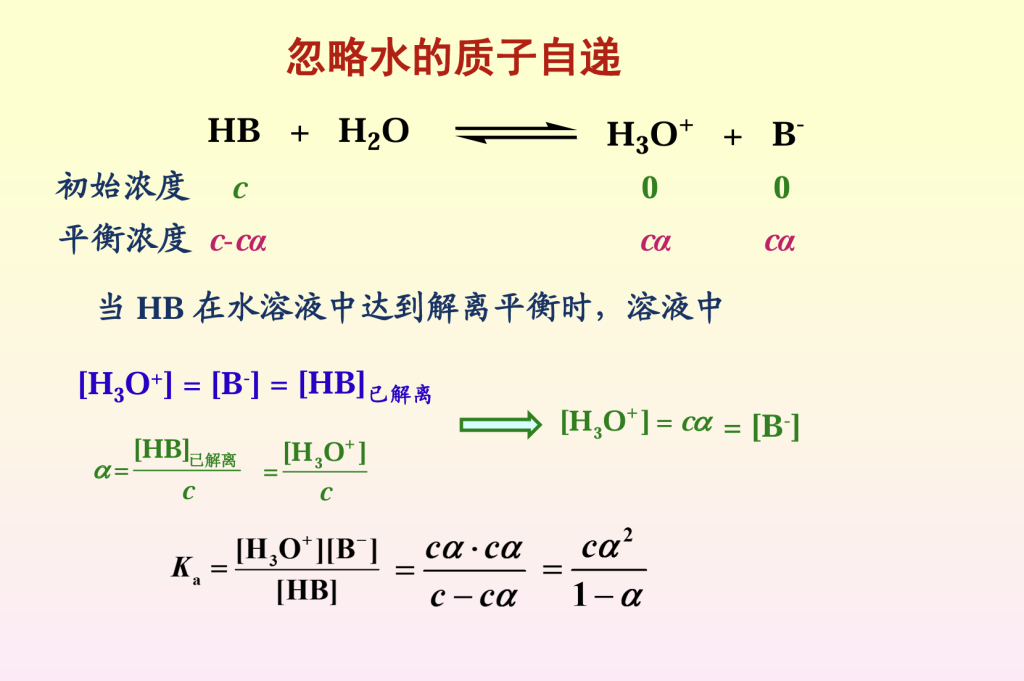
一元酸扔质子生成共轭碱 Ka=[H+]·[B-]/[HB](一元酸质子转移平衡常数,)K越大,分母越小,分子越大,转化的HB越多,酸性越强
一元弱碱碱拿质子生成共轭酸 Kb=[OH-]·[HB]/[B-]
共轭酸碱对酸碱常熟积为水的离子积常数,共轭酸酸性越强,共轭碱越弱,反之亦然,但不能直觉确定酸碱性强弱
多元弱酸
多元酸分布解离,注意共轭酸碱对K的对应
酸的浓度、酸度、强度
酸度指溶液中游离【H3O】的物质的量,酸性指酸给出质子的能力
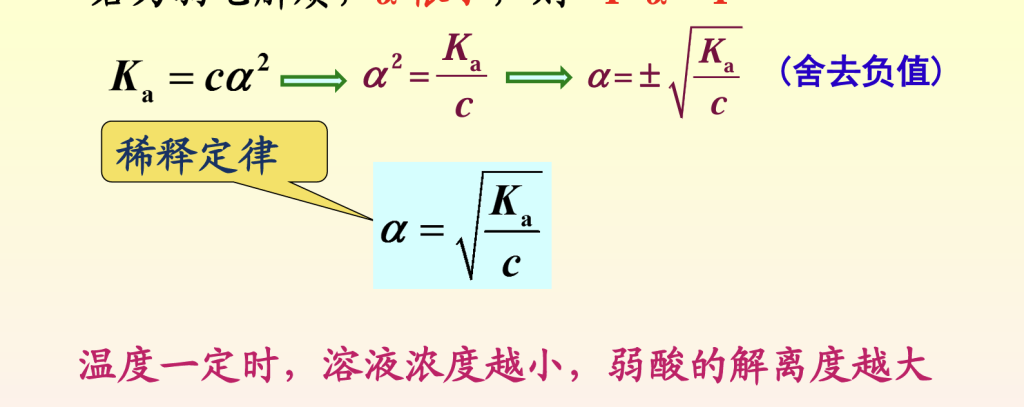
浓度对平衡移动的影响
同离子效应
直接加入的与弱酸弱碱解离产生的离子同种离子会抑制弱酸弱碱的解离
盐效应
不同种离子产生的离子氛会略微促进
pH计算
强酸强碱:
pH可直接求得
强弱酸混合溶液
pH通过强酸求